O que é Massa Atômica?
Sim, massa atômica é a massa de um átomo. Mas ela é medida em uma unidade diferente das unidades de massa que conhecemos (Como grama, libra etc...).A massa atômica (de um átomo) é medida na unidade de massa atômica (u) ou (u.m.a.).
Obs.: 1 u é equivalente (1/12) da massa do átomo de carbono 12 (isótopo do carbono mais abundante na Terra).
 |
| Fonte: www.vestibulandoweb.com.br/ |
Definição
Agora podemos fazer uma definição mais formal de massa atômica:A massa atômica de um elemento químico é a média das massas atômicas dos isótopos desse elemento químico, ponderada pela ocorrência dos variados isótopos.Mas por que pegar 1 doze avos do carbono? Por que não usar o hidrogênio?
Tem duas respostas para essa pergunta:
1) Porque foi definido assim e ponto final. (Resposta do ensino médio)
2) Porque a massa do hidrogênio-1 não é típica. De fato a massa do hidrogênio é significativamente maior que a massa de 1/12 do carbono. E traria dificuldades práticas.
A explicação da resposta dois vai longe, por isso deixo este texto para caso você queria se aprofundar.
Unidades
Além da unidade "u" (Relativa), a massa do átomo também pode ser representada por g (gramas - Absoluta).Neste caso é conveniente a unidade g/mol pois associa a quantidade de átomos (mol)
Vale lembrar que um mol equivale a 6,02 X 10²³ átomos.
Massa na Tabela Periódica
Definido o que é massa atômica de um elemento químico, vou mostrar onde achar a massa atômica na tabela periódica:Veja no exemplo acima que a massa atômica é o número de maior valor dentro do quadrado do elemento químico (Retângulo vermelho para indicar a massa do Cálcio).
No caso do Cálcio podemos dizer que 1 mol de cálcio tem 40g, 40g/mol ou 6,02 X 10²³ átomos de Cálcio.
Mas por que a tabela dá um número quebrado? Bom aí que entra o cálculo da massa atômica dos isótopos...
Cálculo da Massa Atômica
Você já deve ter ouvido falar dos isótopos certo? É importante você entender que átomos podem ter diferentes massas atômicas (Isótopos).
Graças a eles não temos uma massa atômica "redonda" e temos exercícios rsrs.
O cálculo é feito através de uma média ponderada. Isso mesmo! Similar a forma que sua nota final é calculada pela média ponderada das suas notas nos bimestres.
Fórmula
O cálculo funciona da seguinte forma:- Multiplicamos o número de massa de cada isótopo pela sua ocorrência na natureza (porcentagem).
- Somamos os resultados parciais do primeiro passo.
- Dividimos a soma por 100.
Exemplo 1
Vou citar o exemplo fictício do site todamateria.com.br:Temos dois isótopos de um elemento químico qualquer: ²²X ³⁶X. As massas deles são 22u e 36u.
Vamos supor que a ocorrência desses isótopos na natureza é de 40% e 60% respectivamente.
A partir dessas informações já é possível calcular a massa atômica:
Exemplo 2
Considere os três isótopos do neônio na tabela abaixo: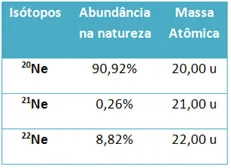 |
| Fonte: alunosonline.uol.com.br |
(20,00 . 90,92) + (21,00 . 0,26) + (22,00 . 8,82)
100
Massa do neônio = 20,179 u
Importante: Não importa quantos isótopos o elemento tenha, basta que você saiba a sua proporção na natureza. Para fins de cálculo basta continuar adicionando o produto de sua ocorrência com sua massa.
Atenção: A soma da ocorrência precisa ser, necessariamente, igual a 100%! Exemplo 1 (40 + 60 = 100%) e Exemplo 2 ( 90,92 + 0,26 + 8,82 = 100%)
Massa Atômica e Massa Molar
Massa molar é a massa de 1 mol do átomo ou molécula. A unidade é g/mol e pode ser lida diretamente da tabela periódica para o caso de átomos.
A massa atômica e a massa molar tem o mesmo valor absoluto. A diferença fica por conta da unidade.
A massa atômica e a massa molar tem o mesmo valor absoluto. A diferença fica por conta da unidade.
Calculando a massa de um átomo
Também podemos usar a massa molar para calcular a massa de um átomo individualmente.
Se 1 mol possui 6,02 X 10²³ átomos (constante de Avogadro), basta dividirmos a massa molar da substância pela número de Avogadro.
Exemplo: Prata (Ag)
A Prata tem massa atômica de aproximadamente 107,9 u ou 107,9 g/mol.
1 mol do elemento prata possui 6,02 X 10²³ átomos de prata. Logo:
Dividindo 107,9g por 6,02 X 10²³ átomos temos 1,79 X 10⁻²² g.
Em outras palavras, 1,79 X 10⁻²² g é o peso de UM átomo de prata.
Outra forma de calcular a massa de um átomo é multiplicar a sua massa relativa pelo valor de "u" em g (gramas). 1 u é igual a 1,66054 . 10⁻²⁴ g.
Massa Atômica e Massa Molecular
A massa molecular é a soma das massas atômicas dos elementos químicos que compõem a molécula. Em outras palavras, apenas moléculas possuem massa molecular.
Exemplo
A molécula de água é formada por dois átomos de hidrogênio e um de oxigênio (H₂O), certo?
E a massa atômica do Hidrogênio é 1 e a do Oxigênio é 16 u.
Dessa forma, a massa molecular da água é a soma dessas massas atômicas da seguinte forma:
H₂O = (H . 2) + (O . 1)
H₂O = (1 u . 2) + (16 u . 1)
H₂O = 18 u
Resumo
Massa atômica é a massa do átomo ou de um grupo de átomos (mol). Ela é medida na unidade "u", "g" ou "g/mol".
1 u é equivalente (1/12) da massa do átomo de carbono 12. Por isso dizemos que a massa atômica é relativa.
O valor da massa atômica pode ser obtida diretamente da tabela periódica ou pode ser calculada, caso tenhamos a sua porcentagem de ocorrência na natureza.
Exercícios
Obs.: O Gabarito está mais abaixo.
1 - (FGV) O cloro é encontrado na natureza em duas formas isotópicas de 35 e 37 unidades de
massa atômica. Dado que a massa atômica média do cloro é de 35,45 uma, qual a percentagem
dos dois isótopos na natureza?
a) 86,7 % ³⁵Cl + 13,3% ³⁷Cl
b) 66,7 % ³⁵Cl + 33,3% ³⁷Cl
c) 80,0 % ³⁵Cl + 20,0% ³⁷Cl
d) 72,2 % ³⁵Cl + 27,8% ³⁷Cl
e) 77,5 % ³⁵Cl + 22,5% ³⁷Cl
2 - (UFSCAR) O elemento magnésio, número atômico 12, ocorre na natureza como uma mistura
de três isótopos. As massas atômicas destes isótopos, expressas em unidades de massa atômica
(u), e suas respectivas abundâncias num dado lote do elemento, são fornecidos na tabela a seguir
A massa atômica para este lote de magnésio, expressa em u, é igual a:
a) 23,98504, exatamente.
b) 24,98584, exatamente.
c) 25,98259, exatamente.
d) um valor compreendido entre 23,98504 e 24,98584.
e) um valor compreendido entre 24,98584 e 25,98259.
1 - (FGV) O cloro é encontrado na natureza em duas formas isotópicas de 35 e 37 unidades de
massa atômica. Dado que a massa atômica média do cloro é de 35,45 uma, qual a percentagem
dos dois isótopos na natureza?
a) 86,7 % ³⁵Cl + 13,3% ³⁷Cl
b) 66,7 % ³⁵Cl + 33,3% ³⁷Cl
c) 80,0 % ³⁵Cl + 20,0% ³⁷Cl
d) 72,2 % ³⁵Cl + 27,8% ³⁷Cl
e) 77,5 % ³⁵Cl + 22,5% ³⁷Cl
2 - (UFSCAR) O elemento magnésio, número atômico 12, ocorre na natureza como uma mistura
de três isótopos. As massas atômicas destes isótopos, expressas em unidades de massa atômica
(u), e suas respectivas abundâncias num dado lote do elemento, são fornecidos na tabela a seguir
| Clique para aumentar |
a) 23,98504, exatamente.
b) 24,98584, exatamente.
c) 25,98259, exatamente.
d) um valor compreendido entre 23,98504 e 24,98584.
e) um valor compreendido entre 24,98584 e 25,98259.
Mais Exercícios para Download
Faça mais exercícios sobre Massa Atômica!
Que tal um incentivo para curtir ou compartilhar este artigo? (Assim você vai ajudar outros colegas a encontrar este blog)
Compartilhe (ou curta) agora e faça o download:










Comentários